近日,国重室放射生物学研究中心畅磊教授课题组在Cancer Research杂志上发表了题为“Ku70 Binding to YAP Alters PARP1 Ubiquitination to Regulate Genome Stability and Tumorigenesis”的文章,该研究通过繁育多种基因敲除小鼠及构建多种肿瘤模型,阐明了Ku70-YAP-PARP1轴在调控和维持基因组稳定性方面不可或缺的作用,为研究YAP/TAZ活性与肿瘤发生过程之间的复杂关系提供新的见解。论文链接:https://aacrjournals.org/cancerres/article-abstract/doi/10.1158/0008-5472.CAN-23-4034/745875/Ku70-Binding-to-YAP-Alters-PARP1-Ubiquitination-to?redirectedFrom=fulltext。
YAP/TAZ是肿瘤发生过程中的核心参与者,其活性与人体的多个器官的多种肿瘤的发生、进展及不良预后密切相关,因此,阐明YAP调控肿瘤发生的具体机制并寻找YAP作用的靶分子,已经成为靶向YAP的抗肿瘤药物开发领域里亟待解决的重要问题。Ku70是DNA损伤修复NHEJ通路的关键蛋白,本研究团队发现,Ku70与转录因子TEAD4动态竞争结合YAP,来影响YAP的转录活性。在正常情况下,Ku70与YAP相互结合形成YAP/Ku70复合物,减弱YAP与TEAD4的结合,限制了YAP的转录活性。而Ku70的缺失或者DNA损伤能够促进YAP/Ku70的解离,增强了YAP与TEAD4之间的相互作用,增强了YAP的转录活性。在体内,采用Ku70特异性敲除的基因小鼠构建肿瘤模型,发现Ku70的缺失能够通过激活YAP,促进结肠癌和肝细胞癌的发生。从机制上来说,YAP激活能够通过提高泛素酶SMURF2的表达,进一步通过泛素-蛋白酶体途径促进DNA损伤应答蛋白PARP1的泛素降解,从而阻碍DNA损伤修复,促进基因组的不稳定性及肿瘤发生(图1)。最后,对临床肝癌患者的组织样本进行分析,进一步证实了Ku70表达、YAP活性、PARP1水平和基因组不稳定性之间的联系。
综上,本研究揭示了YAP与DNA损伤修复关键调控因子Ku70之间相互调控的机制,强调了Ku70-YAP-PARP1轴在保持基因组稳定性中的重要作用,从而为研究靶向YAP的抗肿瘤药物及肿瘤的多学科诊治提供新的治疗策略。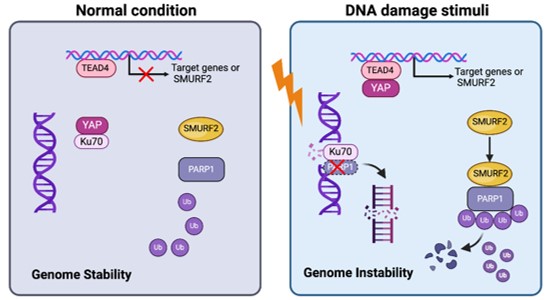
图1 Ku70-YAP-PARP1轴在保持基因组稳定性中的作用机制示意图
放射医学与防护学院2021级博士生舒银银,2023级博士生金晓旎及博士后纪敏涛为该论文的共同第一作者,苏州大学畅磊教授为该论文的通讯作者。该工作得到了国家自然科学基金委员会、霍英东教育基金会、放射医学与辐射防护国家重点实验室、江苏省自然科学基金委员会、江苏省放射医学协同创新中心的共同支持。

